Nimenrix
Ist ein Impfstoff gegen Meningokokken und schützt vor Meningitis (sehr schwere, meist tödlich verlaufende Erkrankung).
Die Kosten für die Impfung in unserer Kinderarztpraxis betragen 70 Euro.
1. BEZEICHNUNG DES ARZNEIMITTELS
Nimenrix® – Pulver und Lösungsmittel zur Herstellung einer Injektionslösung in einer Fertigspritze Meningokokken-Gruppen A, C, W-135 und Y-Konjugatimpfstoff
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Nach Rekonstitution enthält 1 Dosis (0,5 ml):
Neisseria meningitidis-Gruppe A-Polysaccharid* 5 Mikrogramm
Neisseria meningitidis-Gruppe C-Polysaccharid* 5 Mikrogramm
Neisseria meningitidis-Gruppe W-135-Polysaccharid* 5 Mikrogramm
Neisseria meningitidis-Gruppe Y-Polysaccharid* 5 Mikrogramm
*konjugiert an Tetanustoxoid-Trägerprotein 44 Mikrogramm
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Das Pulver bzw. der Pulverkuchen ist weiß. Das Lösungsmittel ist klar und farblos.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Nimenrix ist indiziert zur aktiven Immunisierung von Personen ab einem Alter von 6 Wochen gegen invasive Meningokokkenerkrankungen, verursacht durch Neisseria meningitidis der Gruppen A, C, W-135 und Y.
4.2 Dosierung und Art der Anwendung
Dosierung
Die Anwendung von Nimenrix sollte gemäß offiziellen Empfehlungen erfolgen.
Säuglinge im Alter von 6 bis 12 Wochen Das empfohlene Immunisierungsschema besteht aus 3 Dosen zu jeweils 0,5 ml. Die Grundimmunisierung besteht aus 2 Dosen, wobei die erste Dosis ab einem Alter von 6 Wochen gegeben wird und zwischen den Dosen ein Abstand von 2 Monaten eingehalten wird. Die dritte Dosis
(Auffrischimpfung) wird im Alter von 12 Monaten empfohlen (siehe Abschnitt 5.1).
Kinder ab einem Alter von 12 Monaten, Jugendliche und Erwachsene Es sollte 1 Einzeldosis zu 0,5 ml verabreicht werden. Bei manchen Personen kann die Verabreichung einer zweiten Dosis Nimenrix in Betracht gezogen werden (siehe Abschnitt 4.4).
Zuvor geimpfte Kinder ab einem Alter von 12 Monaten, Jugendliche und Erwachsene Nimenrix kann als Auffrischimpfung an Personen verabreicht werden, die zuvor eine Grundimmunisierung mit einem Konjugat- oder einfachen Polysaccharid-Meningokokken-Impfstoff erhalten haben (siehe Abschnitte 4.4 und 5.1).
Art der Anwendung
Nimenrix ist ausschließlich intramuskulär zu injizieren.
Bei Säuglingen wird als Injektionsstelle der anterolaterale Bereich des Oberschenkels empfohlen. Bei Personen ab einem Alter von 1 Jahr wird als Injektionsstelle der anterolaterale Bereich des Oberschenkels oder der M. deltoideus empfohlen (siehe Abschnitte 4.4 und 4.5).
Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nimenrix darf unter keinen Umständen intravasal, intradermal oder subkutan verabreicht werden.
Der Impfung sollten eine Anamneseerhebung (unter besonderer Berücksichtigung früherer Impfungen und eventuell aufgetretener Nebenwirkungen) sowie eine klinische Untersuchung vorausgehen.
Für den seltenen Fall einer anaphylaktischen Reaktion nach Verabreichung des Impfstoffes sollten stets entsprechende medizinische Behandlungs- und Überwachungsmöglichkeiten sofort verfügbar sein.
Interkurrente Erkrankung
Die Impfung mit Nimenrix sollte bei Personen, die an einer akuten, schweren, mit Fieber einhergehenden Erkrankung leiden, auf einen späteren Zeitpunkt verschoben werden. Ein banaler Infekt (wie z. B. eine Erkältung) stellt jedoch keine Kontraindikation für eine Impfung dar.
Ohnmacht
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Ohnmacht kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-
klonische Bewegungen der Gliedmaßen begleitet sein. Es ist wichtig, Maßnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Thrombozytopenie und Blutgerinnungsstörungen
Bei Personen mit Thrombozytopenie oder einer Blutgerinnungsstörung ist Nimenrix mit Vorsicht zu verabreichen, da es bei diesen Personen nach intramuskulärer Injektion zu Blutungen kommen kann.
Immundefizienz
Es wird möglicherweise bei Patienten unter immunsuppressiver Therapie oder mit geschwächtem Immunsystem keine ausreichende Immunantwort erreicht.
Personen mit angeborener Komplementdefizienz (zum Beispiel C5- oder C3-Mangel) sowie Personen, die mit Arzneimitteln behandelt werden, die die Aktivierung des terminalen Komplements hemmen (z. B. Eculizumab), haben ein erhöhtes Risiko einer durch Neisseria meningitidis der Gruppen A, C, W-135 und Y verursachten invasiven Erkrankung, auch wenn sie Antikörper nach der Impfung mit Nimenrix entwickeln.
Schutz vor Meningokokkenerkrankungen
Nimenrix wird nur einen Schutz vor Neisseria meningitidis der Gruppen A, C, W-135 und Y verleihen. Der Impfstoff wird nicht vor anderen Neisseria meningitidis-Gruppen schützen. Es wird möglicherweise nicht bei allen Geimpften eine schützende Immunantwort erzielt.
Auswirkungen einer vorhergehenden Impfung mit einem einfachen Polysaccharid-Meningokokken-Impfstoff Personen, die zuvor schon einmal eine Impfung mit einem einfachen Polysaccharid-Meningokokken-Impfstoff erhalten haben und 30 bis 42 Monate später mit Nimenrix geimpft wurden, hatten niedrigere
geometrische Mitteltiter (GMTs, gemessen mit einem Test auf bakterizide Antikörper im Serum unter Verwendung von Kaninchen-Komplement [rSBA]) als Personen, die in den vergangenen 10 Jahren keinen Meningokokken-Impfstoff erhalten haben (siehe Abschnitt 5.1). Die klinische Relevanz dieser
Beobachtung ist nicht bekannt.
Auswirkung von vor der Impfung vorhandenen Antikörpern gegen das Tetanustoxoid Die Sicherheit und Immunogenität von Nimenrix wurde bei aufeinanderfolgender oder gleichzeitiger Verabreichung eines Impfstoffs mit Diphtherie- und Tetanustoxoiden, azellulärem Pertussis,
inaktivierten Polioviren (1, 2 und 3), Hepatitis-B-Oberflächenantigen und Haemophilus influenzae Typ b-Polyribosyl-Ribose-Phosphat konjugiert an Tetanustoxoid (DTPa-HBV-IPV/Hib) im zweiten Lebensjahr untersucht. Die Verabreichung von Nimenrix einen Monat nach der DTPa-HBV-IPV/Hib-
Impfung resultierte in niedrigeren rSBA-GMTs gegen die Gruppen A, C und W-135 im Vergleich zur gleichzeitigen Verabreichung (siehe Abschnitt 4.5). Die klinische Relevanz dieser Beobachtung ist nicht bekannt.
Immunantwort bei Kleinkindern im Alter von 12 bis 14 Monaten Kleinkinder im Alter von 12 bis 14 Monaten zeigten einen Monat nach der Impfung mit einer Dosis
Nimenrix oder einen Monat nach der Impfung mit der zweiten Dosis Nimenrix im Abstand von zwei Monaten ähnliche Antikörperantworten (rSBA) auf die Gruppen A, C, W-135 und Y.
Eine Einzeldosis ging im Vergleich zu 2 Dosen im Abstand von zwei Monaten mit niedrigeren hSBA (human complement serum bactericidal assay)-Titern für die Gruppen W-135 und Y einher. Die Antworten auf die Gruppen A und C nach einer bzw. zwei Dosen waren ähnlich (siehe Abschnitt 5.1).
Die klinische Relevanz dieser Ergebnisse ist nicht bekannt. Wenn bei einem Kleinkind ein besonderes Risiko für eine invasive Meningokokkenerkrankung aufgrund einer Exposition gegenüber den Gruppen W-135 und Y erwartet wird, kann nach einem Intervall von 2 Monaten die Verabreichung
einer zweiten Dosis Nimenrix in Betracht gezogen werden. Zur Abnahme der Antikörpertiter gegen Gruppe A oder Gruppe C nach einer ersten Dosis Nimenrix bei Kindern im Alter von 12 bis 23 Monaten, siehe „Persistenz der bakteriziden Serum-Antikörpertiter“.
Persistenz der bakteriziden Serum-Antikörpertiter
Nach der Gabe von Nimenrix findet man unter Verwendung von humanem Komplement in der Testung (hSBA) eine Abnahme der bakteriziden Serum-Antikörpertiter gegen Gruppe A (siehe Abschnitt 5.1). Die klinische Relevanz der Abnahme der hSBA-Antikörpertiter gegen Gruppe A ist
nicht bekannt. Wenn jedoch für eine Person ein besonderes Risiko für eine Exposition gegenüber Gruppe A zu erwarten ist und eine Dosis Nimenrix vor mehr als ca. einem Jahr verabreicht wurde, kann die Gabe einer Auffrischimpfung in Betracht gezogen werden.
Es wurde eine Abnahme der Antikörpertiter über die Zeit für die Gruppen A, C, W-135 und Y beobachtet. Die klinische Relevanz der abnehmenden Antikörpertiter ist nicht bekannt. Bei Personen, die im Kleinkindalter geimpft wurden und weiterhin einem hohen Risiko für eine Meningokokkenerkrankung, verursacht durch die Gruppen A, C, W-135 oder Y, ausgesetzt sind, kann eine Auffrischimpfung in Betracht gezogen werden (siehe Abschnitt 5.1).
Auswirkung von Nimenrix auf Anti-Tetanus-Antikörperkonzentrationen
Obwohl nach einer Impfung mit Nimenrix ein Anstieg der Anti-Tetanustoxoid (TT)-Antikörperkonzentrationen beobachtet wurde, ersetzt Nimenrix nicht eine Immunisierung gegen Tetanus.
Die Verabreichung von Nimenrix im zweiten Lebensjahr gleichzeitig mit oder einen Monat vor einem Tetanustoxoid-haltigen Impfstoff beeinträchtigt weder die Immunantwort auf Tetanustoxoid noch wird die Sicherheit signifikant beeinflusst. Es liegen keine Daten bei Personen über 2 Jahren vor.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Säuglingen kann Nimenrix gleichzeitig mit kombinierten DTPa-HBV-IPV/Hib-Impfstoffen sowie 10-valenten Pneumokokken-Konjugatimpfstoffen verabreicht werden.
Ab einem Alter von 1 Jahr kann Nimenrix gleichzeitig mit jedem der folgenden Impfstoffe verabreicht werden: Hepatitis A (HAV)- und Hepatitis B (HBV)-Impfstoffe, Masern-Mumps-Röteln (MMR)-Impfstoff, Masern-Mumps-Röteln-Varizellen (MMRV)-Impfstoff, 10-valenter Pneumokokken-Konjugatimpfstoff oder nicht-adjuvantierter saisonaler Influenzaimpfstoff.
Im zweiten Lebensjahr kann Nimenrix auch gleichzeitig mit kombinierten Diphtherie-Tetanus-azellulären Pertussis (DTPa)-Impfstoffen verabreicht werden, einschließlich kombinierten DTPa-Impfstoffen mit Hepatitis B, Poliovirus inaktiviert oder Haemophilus influenzae Typ b (HBV, IPV oder Hib), wie zum Beispiel einem DTPa-HBV-IPV/Hib-Impfstoff, und mit 13-valentem Pneumokokken-Konjugatimpfstoff.
Bei Personen im Alter von 9 bis 25 Jahren kann Nimenrix gleichzeitig mit einem rekombinanten bivalenten Impfstoff gegen humane Papillomaviren des Typs 16 und 18 (HPV2) verabreicht werden.
Wann immer möglich sollten Nimenrix und ein TT-haltiger Impfstoff, wie zum Beispiel ein DTPa-HBV-IPV/Hib-Impfstoff, gleichzeitig verabreicht werden, oder Nimenrix sollte mindestens einen Monat vor dem TT-haltigen Impfstoff appliziert werden.
Einen Monat nach der gleichzeitigen Verabreichung eines 10-valenten Pneumokokken-Konjugatimpfstoffes wurden niedrigere mittlere geometrische Antikörperkonzentrationen (GMCs) und Opsonophagozytose-Test (OPA)-Antikörper-GMTs für einen Pneumokokken-Serotyp (18C,
konjugiert an Tetanustoxoid-Trägerprotein) beobachtet. Die klinische Relevanz dieser Beobachtung ist nicht bekannt. Die gleichzeitige Verabreichung hatte keine Auswirkungen auf die Immunantworten auf die anderen neun Pneumokokken-Serotypen.
Einen Monat nach der gleichzeitigen Verabreichung mit einem adsorbierten Kombinationsimpfstoff aus Tetanus-Toxoid, Diphtherie-Toxoid (reduzierter Gehalt) und azellulärem Pertussis-Antigen (Tdap) bei Personen im Alter von 9 bis 25 Jahren wurden für jedes Pertussis-Antigen (Pertussis-Toxoid [PT], filamentöses Hämagglutinin [FHA] und Pertactin [PRN]) niedrigere GMCs beobachtet. Mehr als 98 % der Personen hatten Anti-PT-, FHA- oder PRN-Konzentrationen oberhalb des Schwellenwertes der Untersuchung. Die klinische Relevanz dieser Beobachtung ist nicht bekannt. Die gleichzeitige Verabreichung hatte keine Auswirkungen auf die Immunantworten auf Nimenrix oder die in Tdap enthaltenen Tetanus- oder Diphtherie-Antigene.
Falls Nimenrix gleichzeitig mit anderen injizierbaren Impfstoffen verabreicht wird, sollten die Impfstoffe immer in verschiedene Gliedmaßen injiziert werden.
Bei Patienten unter immunsuppressiver Therapie wird möglicherweise keine ausreichende Immunantwort erzielt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Bisher liegen nur begrenzte Erfahrungen mit der Anwendung von Nimenrix bei Schwangeren vor.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die Schwangerschaft, embryonale/ fetale Entwicklung, Geburt oder postnatale Entwicklung (siehe Abschnitt 5.3).
Nimenrix sollte während der Schwangerschaft nur angewendet werden, wenn dies unbedingt notwendig ist und die möglichen Vorteile die potentiellen Risiken für den Fötus überwiegen.
Stillzeit
Es ist nicht bekannt, ob Nimenrix in die Muttermilch übergeht.
Nimenrix sollte während der Stillzeit nur verabreicht werden, wenn die möglichen Vorteile die potentiellen Risiken überwiegen.
Fertilität
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die Fertilität.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen durchgeführt. Einige der im Abschnitt 4.8 genannten Nebenwirkungen können jedoch die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen beeinflussen.
4.8 Nebenwirkungen
Zusammenfassung des Nebenwirkungsprofils
Das in der anschließenden Tabelle dargestellte Sicherheitsprofil von Nimenrix basiert auf den folgenden zwei klinischen Studien-Datensätzen:
- Einer gepoolten Analyse der Daten von 9.621 Personen, die eine Einzeldosis Nimenrix erhielten. Davon waren 3.079 Kleinkinder (12 bis 23 Monate), 909 Kinder zwischen 2 und 5 Jahren, 990 Kinder zwischen 6 und 10 Jahren, 2.317 Jugendliche (11 bis 17 Jahre) und 2.326 Erwachsene (18 bis 55 Jahre).
- In einer gesonderten Studie wurde eine Einzeldosis Nimenrix 274 Personen im Alter von 56 Jahren und älter verabreicht.
- Daten aus einer Studie an Säuglingen im Alter von 6 bis 12 Wochen zum Zeitpunkt der ersten Dosis (Studie MenACWY-TT-083). 1.052 Säuglinge erhielten mindestens eine Dosis einer Grundimmunisierung mit 2 oder 3 Dosen Nimenrix und 1.008 erhielten im Alter von etwa 12 Monaten eine Auffrischimpfung.
Lokale und allgemeine Nebenwirkungen
In den Altersgruppen von 6 bis 12 Wochen sowie 12 bis 14 Monaten, die 2 Dosen Nimenrix im Abstand von 2 Monaten erhielten, waren die erste und zweite Dosis mit einer jeweils ähnlichen lokalen und systemischen Reaktogenität assoziiert.
Das lokale und allgemeine Nebenwirkungsprofil einer Auffrischimpfung mit Nimenrix, die Personen im Alter von 12 Monaten bis 30 Jahren nach der Grundimmunisierung mit Nimenrix oder anderen Konjugat- oder einfachen Polysaccharid-Meningokokken-Impfstoffen verabreicht wurde, war ähnlich
dem lokalen und allgemeinen Nebenwirkungsprofil nach der Grundimmunisierung mit Nimenrix, mit Ausnahme gastrointestinaler Symptome (einschließlich Durchfall, Erbrechen und Übelkeit), die bei Personen ab dem Alter von 6 Jahren sehr häufig auftraten.
Tabellarische Liste von Nebenwirkungen
Die Häufigkeit der berichteten Nebenwirkungen ist in folgende Kategorien eingeteilt:
Sehr häufig: (≥ 1/10) – größer gleich 10%
Häufig: (≥ 1/100 bis < 1/10) – zwischen 1% und 10%
Gelegentlich: (≥ 1/1.000 bis < 1/100) – zwischen 0,1% und 1%
Selten: (≥ 1/10.000 bis < 1/1.000) – zwischen 0,01% und 0,1%
Sehr selten: (< 1/10.000) – weniger als 0,01%
Systemorganklasse: Stoffwechsel- und Ernährungsstörungen
Häufigkeit: Sehr häufig – Nebenwirkungen: Appetitlosigkeit
Systemorganklasse: Psychiatrische Erkrankungen
Häufigkeit: Sehr häufig – Nebenwirkungen: Reizbarkeit
Häufigkeit: Gelegentlich – Nebenwirkungen: Schlaflosikgeit, Schreien
Systemorganklasse: Erkrankungen des Nervensystems
Häufigkeit: Sehr häufig – Nebenwirkungen: Schläfrigheit, KopfschmerzenHypäthesien
Häufigkeit: Gelegentlich – Nebenwirkungen: Schwindel
Systemorganklasse: Erkrankungen des Gastrointestinaltrakts
Häufigkeit: häufig – Nebenwirkungen: Durchfall, Erbrechen, Übelkeit*
Systemorganklasse: Erkrankung der Haut
Häufigkeit: Gelegentlich – Nebenwirkungen: Pruritus Hautausschlag**
Systemorganklasse: Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
Häufigkeit: Gelegentlich – Nebenwirkungen: Myalgie, Schmerzen in den Extremitäten
Systemorganklasse: Allgemeine Erkrankungen und Beschwerden am Verabreichungsort
Häufigkeit: Sehr häufig
Nebenwirkungen: Fieber, Schwellung an der Injektionsstelle, Schmerzen an der Injektionsstelle, Rötung an der
Injektionsstelle, Müdigkeit
Häufigkeit: Häufig
Nebenwirkungen: Hämatom an der Injektionsstelle*
Häufigkeit: Gelegentlich
Nebenwirkungen: Unwohlsein, Verhärtung der Injektionsstelle, Pruritus an der Injektionsstelle, Wärme an der Injektionsstelle, Schmerzempfindlichkeit
an der Injektionsstelle
Häufigkeit: nicht bekannt***
Nebenwirkungen: Ausgedehnte Schwellung an den Extremitäten, an der die Injektion vorgenommen wurde, oft verbunden mit einem Erythem, manchmal
unter Einbeziehung des angerenzenden Gelenks oder Schwellung der gesamten Extremität, an der die Injektion vorgenommen wurde.
* Übelkeit und Hämatom an der Injektionsstelle traten bei Säuglingen gelegentlich auf
** Ausschlag trat bei Säuglingen häufig auf
*** Nebenwirkung nach der Zulassung bekannt geworden.
In Tabelle 1 sind die Nebenwirkungen aufgeführt, die in den Studien bei Personen im Alter von 6 Wochen bis 55 Jahren und während der Anwendung nach der Zulassung berichtet wurden. Die Nebenwirkungen bei Personen über 55 Jahren waren ähnlich denen, die bei jüngeren Erwachsenen beobachtet wurden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das aufgeführte nationale Meldesystem anzuzeigen.
Deutschland
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel
Paul-Ehrlich-Institut
Paul-Ehrlich-Straße 51-59
63225 Langen
Telefon: +49 6 10 37 70
Telefax: +49 61 03 77 12 34
Website: www.pei.de
Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Traisengasse 5
1200 WIEN
ÖSTERREICH
Fax: +43 (0) 50 555 36207
Website: http://www.basg.gv.at/
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Impfstoffe, Meningokokken-Impfstoffe, ATC-Code: J07AH08
Wirkmechanismus
Antikapsuläre Meningokokken-Antikörper schützen vor Meningokokkenerkrankungen durch Komplement-vermittelte bakterizide Aktivität. Nimenrix induziert die Produktion von bakteriziden Antikörpern gegen Kapsel-Polysaccharide von Neisseria meningitidis der Gruppen A, C, W-135 und Y, gemessen mit Testsystemen, bei denen entweder Kaninchen-Komplement (rSBA) oder humanes Komplement (hSBA) verwendet wird.
Immunogenität bei Säuglingen
In der klinischen Studie an Säuglingen (MenACWY-TT-083) wurde die erste Dosis im Alter von 6 bis 12 Wochen verabreicht, die zweite Dosis im Abstand von 2 Monaten und die dritte (Auffrischdosis) im Alter von etwa 12 Monaten. Gleichzeitig wurden ein DTPa-HBV-IPV/Hib- und ein 10-valenter Pneumokokken-Impfstoff verabreicht. Nimenrix löste eine bakterizide Antikörperantwort gegen die vier Meningokokken-Gruppen aus, wobei die Antwort auf die Gruppe C hinsichtlich der Prozentwerte der rSBA-Titer ≥ 8 einen Monat nach der zweiten Dosis gegenüber derjenigen der zugelassenen MenC-CRM- und MenC-TT-Impfstoffe nicht unterlegen war. Siehe Tabelle 2.
Tabelle 2: Bakterizide Antikörperantworten (rSBA* und hSBA**) bei Säuglingen nach zwei Dosen im Abstand von 2 Monaten und einer Auffrischdosis im Alter von
12 Monaten (Studie MenACWY-TT-083)
Immunogenität durchgeführt.
*rSBA-Testung durchgeführt in Laboratorien von Public Health England (PHE) im Vereinigten Königreich
**hSBA in GSK-Laboratorien getestet
(1) Entnahme der Blutproben 21 bis 48 Tage nach der Impfung
Immunogenität bei Kleinkindern im Alter von 12 bis 23 Monaten
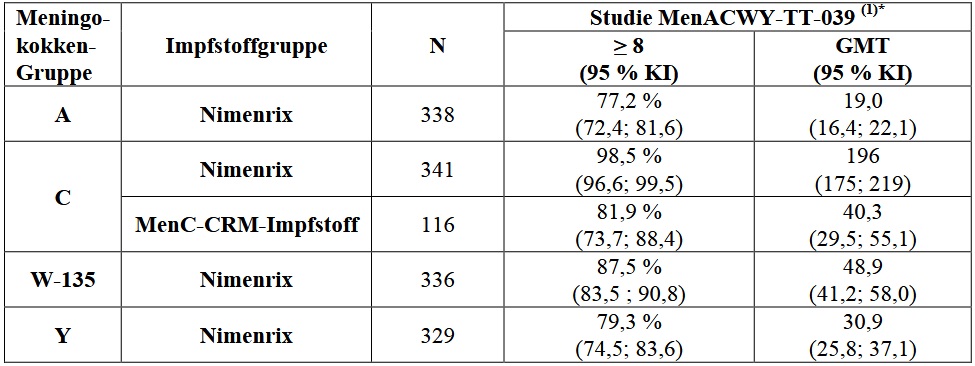
In den klinischen Studien MenACWY-TT-039 und MenACWY-TT-040 löste eine Einzeldosis Nimenrix rSBA-Antworten gegen die vier Meningokokken-Gruppen aus, wobei die Antwort auf die Gruppe C hinsichtlich der Prozentwerte der rSBA-Titer ≥ 8 vergleichbar mit derjenigen des zugelassenen MenC-CRM-Impfstoffes war (Tabelle 3).
Tabelle 3: Bakterizide Antikörperantworten (rSBA*) bei Kleinkindern im Alter von 12 bis 23 Monaten
Die Immunogenitätsanalyse wurde in den ATP-Kohorten für Immunogenität durchgeführt
(1) Entnahme der Blutproben 42 bis 56 Tage nach der Impfung
(2) Entnahme der Blutproben 30 bis 42 Tage nach der Impfung
* in GSK-Laboratorien getestet
In der Studie MenACWY-TT-039 wurde als sekundärer Endpunkt auch die bakterizide Aktivität im Serum, unter Verwendung von humanem Serum als Quelle für das Komplement (hSBA), gemessen (Tabelle 4).
Tabelle 4: Bakterizide Antikörperantworten (hSBA*) bei Kleinkindern im Alter von 12 bis 23 Monaten
Die Immunogenitätsanalyse wurde in den ATP-Kohorten für Immunogenität durchgeführt.
(1) Entnahme der Blutproben 42 bis 56 Tage nach der Impfung
* in GSK-Laboratorien getestet
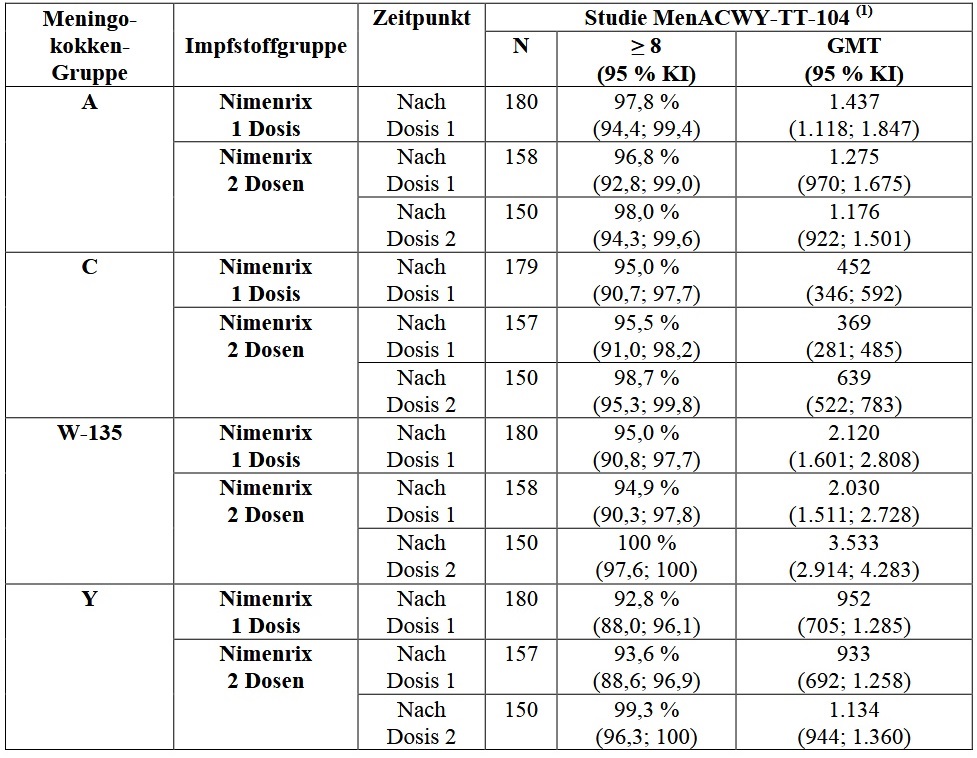
In der Studie MenACWY-TT-104 wurde die Immunantwort nach einer oder zwei Dosen Nimenrix, verabreicht im Abstand von 2 Monaten, gemessen. Die Messung erfolgte einen Monat nach der letzten Impfung. Nimenrix löste eine bakterizide Antikörperantwort gegen alle vier Gruppen aus, die hinsichtlich der Prozentwerte der rSBA-Titer ≥ 8 und GMT nach einer Dosis bzw. zwei Dosen vergleichbar war (Tabelle 5).
Tabelle 5: Bakterizide Antikörperantworten (rSBA*) bei Kleinkindern im Alter von 12 bis 14 Monaten
Die Immunogenitätsanalyse wurde in den ATP (gemäß Prüfplan)-Kohorten für Immunogenität durchgeführt.
(1) Entnahme der Blutproben 21 bis 48 Tage nach der Impfung
* in Public Health England-Laboratorien getestet
In der Studie MenACWY-TT-104 wurde als sekundärer Endpunkt auch die bakterizide Aktivität im Serum unter Verwendung von hSBA gemessen. Nimenrix löste bakterizide Antikörperantworten gegen die Gruppen W-135 und Y aus, die hinsichtlich der Prozentwerte für hSBA-Titer ≥ 8 höher waren, wenn zwei Dosen im Vergleich zu einer gegeben wurden. Ähnliche Antworten in Bezug auf die Prozentwerte der hSBA-Titer ≥ 8 wurden für die Gruppen A und C beobachtet (Tabelle 6).
Tabelle 6: Bakterizide Antikörperantworten (hSBA*) bei Kleinkindern im Alter von 12 bis 14 Monaten
Die Immunogenitätsanalyse wurde in den ATP (gemäß Prüfplan)-Kohorten für Immunogenität durchgeführt.
(1) Entnahme der Blutproben 21 bis 48 Tage nach der Impfung
* in GSK-Laboratorien getestet
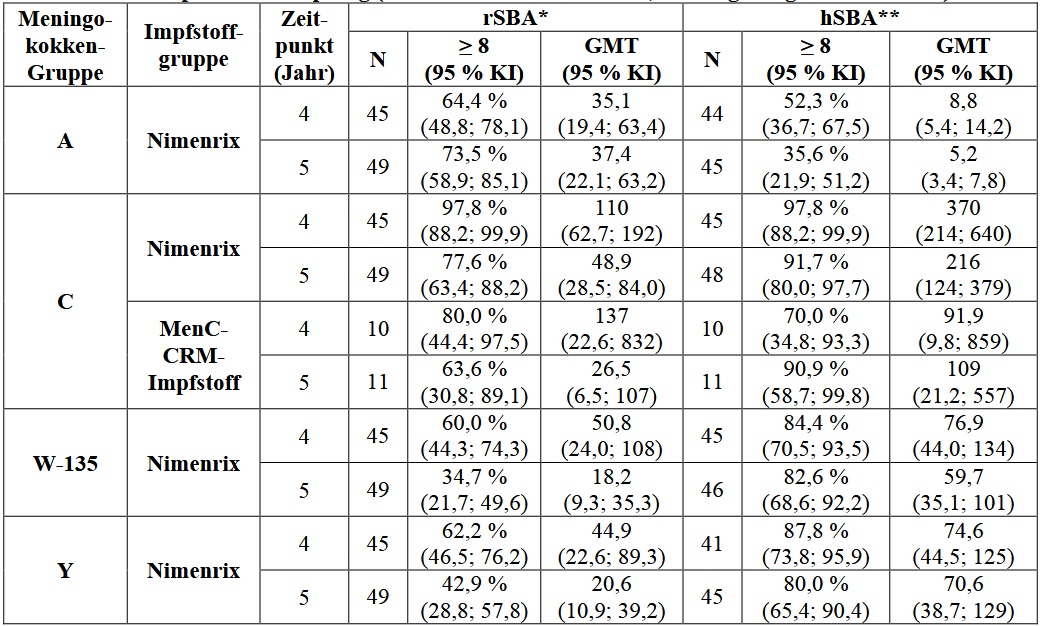
Die Persistenz der Immunantwort wurde anhand von rSBA und hSBA bis zu 5 Jahre bei Kindern untersucht, die ursprünglich in der Studie MenACWY-TT-027 geimpft worden waren (Tabelle 7).
Tabelle 7: 5-Jahres-Persistenzdaten bei Kleinkindern im Alter von 12 bis 23 Monaten zum Zeitpunkt der Impfung (Studie MenACWY-TT-032, Verlängerung der Studie 027)
Die Persistenz der Immunogenität wurde in der ATP-Kohorte in Jahr 5 analysiert. Eine Verzerrung der Auswahl insbesondere aufgrund einer erneuten Impfung von Probanden mit Gruppe C-rSBA-Titer < 8 und ihres Ausschlusses von späteren Zeitpunkten kann zu einer Überschätzung der Titer geführt haben.
* rSBA-Testung durchgeführt in PHE-Laboratorien im Vereinigten Königreich
** in GSK-Laboratorien getestet
Immunogenität bei Kindern im Alter von 2 bis 10 Jahren
In Studie MenACWY-TT-081 wurde für Nimenrix die Nicht-Unterlegenheit gegenüber einem anderen zugelassenen MenC-CRM-Impfstoff hinsichtlich der Immunantwort auf Gruppe C gezeigt [94,8 % (95 % KI: 91,4; 97,1) bzw. 95,7 % (95 % KI: 89,2; 98,8)]. Der GMT war in der Nimenrix-Gruppe [2.795 (95 % KI: 2.393; 3.263)] im Vergleich zum MenC-CRM-Impfstoff [5.292 (95 % KI: 3.815; 7.340)] niedriger.
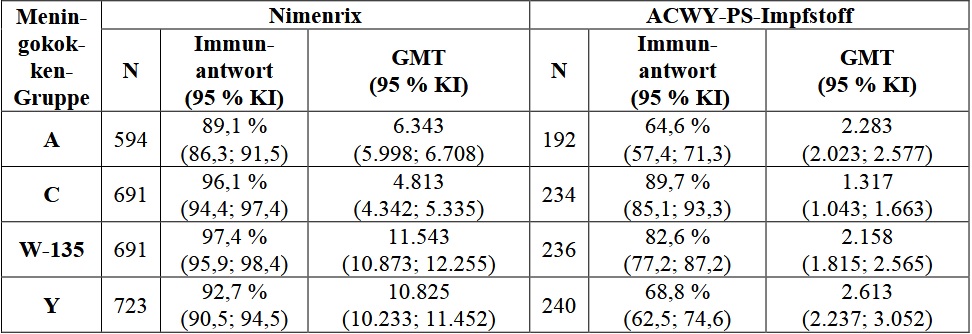
In Studie MenACWY-TT-038 wurde für Nimenrix die Nicht-Unterlegenheit gegenüber dem zugelassenen ACWY-PS-Impfstoff hinsichtlich der Immunantwort auf die vier Serogruppen (A, C, W-135 und Y) gezeigt (siehe Tabelle 8).
Tabelle 8: Bakterizide Antikörperantworten (rSBA*) auf Nimenrix und auf den ACWY-PS-Impfstoff bei Kindern im Alter von 2 bis 10 Jahren einen Monat nach der Impfung
Die Immunogenitätsanalyse wurde in der ATP-Kohorte für Immunogenität durchgeführt.
Immunantwort definiert als Anteil an Probanden mit:
- rSBA-Titer >= 32 für zu Beginn seronegative Probanden (d. h. rSBA-Titer < 8 vor der Impfung)
- mindestens 4-fachem Anstieg der rSBA-Titer nach der Impfung im Vergleich zu vor der Impfung
für zu Beginn seropositive Probanden (d. h. rSBA-Titer ≥ 8 vor der Impfung)
* in GSK-Laboratorien getestet
Die Persistenz der Immunantwort wurde bei ursprünglich in Studie MenACWY-TT-081 geimpften Kindern untersucht (Tabelle 9).
Tabelle 9: 44-Monats-Persistenzdaten bei Kindern im Alter von 2 bis 10 Jahren zum Zeitpunkt
der Impfung (Studie MenACWY-TT-088, Verlängerung der Studie 081)
Die Immunogenitätsanalyse wurde in der für jeden Zeitpunkt angepassten ATP-Kohorte für Persistenz durchgeführt.
* rSBA-Testung durchgeführt in PHE-Laboratorien im Vereinigten Königreich
** in GSK-Laboratorien getestet
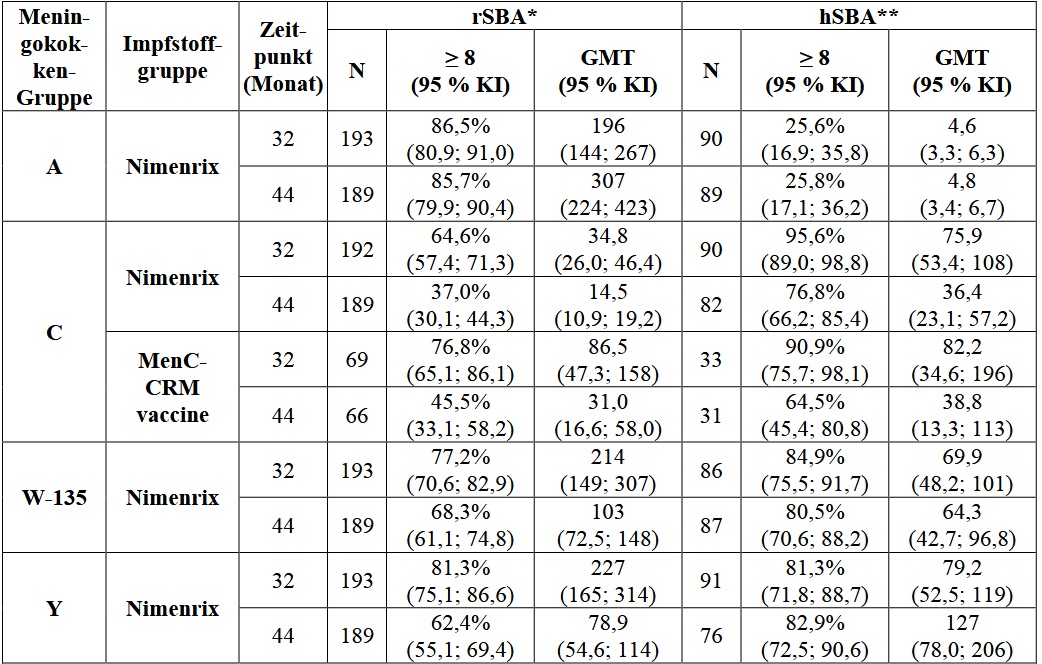
Die Persistenz der Immunantwort wurde anhand von hSBA ein Jahr nach der Impfung von Kindern im Alter von 6 bis 10 Jahren untersucht, die ursprünglich in der Studie MenACWY-TT-027 geimpft worden waren (Tabelle 10) (siehe Abschnitt 4.4).
Tabelle 10: Daten 1 Monat nach der Impfung und 1-Jahres-Persistenzdaten (hSBA*) bei Kindern im Alter von 6 bis 10 Jahren
Die Immunogenitätsanalyse wurde in der ATP-Kohorte für Persistenz durchgeführt.
* in GSK-Laboratorien getestet
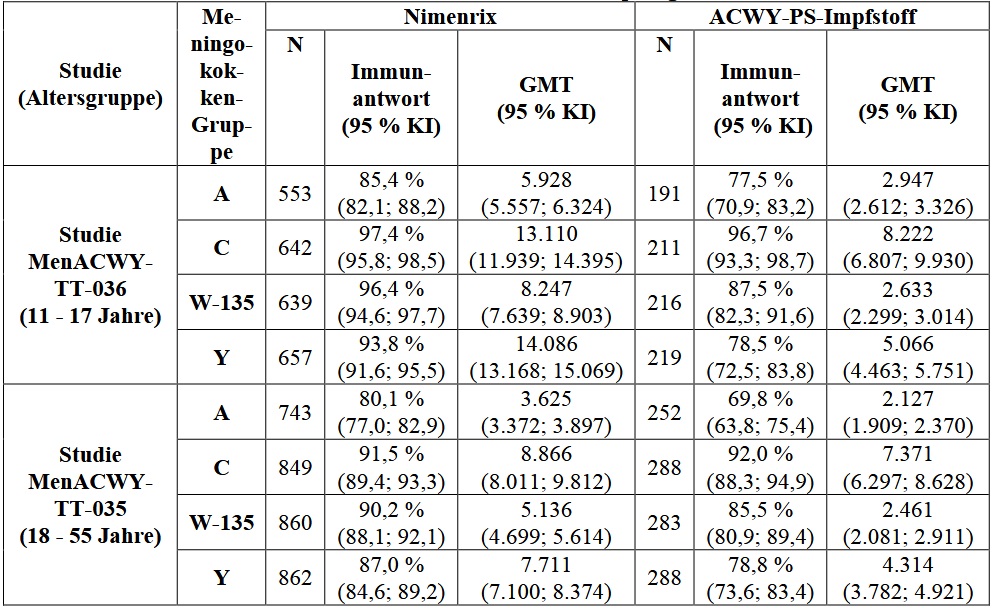
Immunogenität bei Jugendlichen im Alter von 11 bis 17 Jahren und Erwachsenen im Alter von 18 Jahren und älter
In zwei klinischen Studien, die mit Jugendlichen im Alter von 11 bis 17 Jahren (Studie MenACWY-TT-036) und Erwachsenen im Alter von 18 bis 55 Jahren (Studie MenACWY-TT-035) durchgeführt wurden, wurde entweder eine Dosis Nimenrix oder eine Dosis des ACWY-PS-Impfstoffes verabreicht.
Für Nimenrix wurde die immunologische Nicht-Unterlegenheit gegenüber dem ACWY-PS-Impfstoff hinsichtlich der oben definierten Immunantwort (Tabelle 11) gezeigt.
Tabelle 11: Bakterizide Antikörperantworten (rSBA*) auf Nimenrix und auf den ACWY-PS-Impfstoff bei Jugendlichen im Alter von 11 bis 17 Jahren und Erwachsenen im Alter von 18 Jahren und älter einen Monat nach der Impfung
Die Immunogenitätsanalyse wurde in den ATP-Kohorten für Immunogenität durchgeführt.
* in GSK-Laboratorien getestet
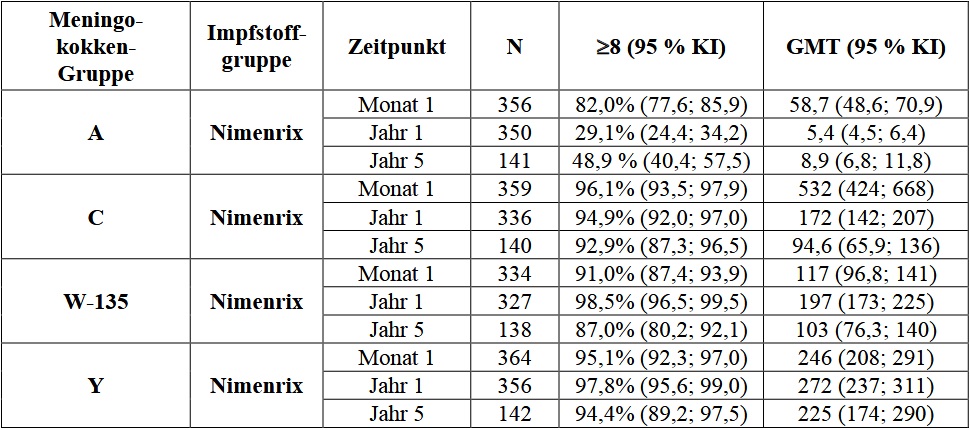
Die Persistenz der Immunantwort bei Jugendlichen, die in der Studie MenACWY-TT-036 grundimmunisiert worden waren, wurde bis zu 5 Jahre nach der Impfung untersucht (Tabelle 12).
Tabelle 12: 5-Jahres-Persistenzdaten (rSBA*) bei Jugendlichen im Alter von 11 bis 17 Jahren zum Zeitpunkt der Impfung

Die Immunogenitätsanalyse wurde in der für jeden Zeitpunkt angepassten ATP-Kohorte für Persistenz durchgeführt.
* rSBA-Testung durchgeführt in PHE-Laboratorien im Vereinigten Königreich.
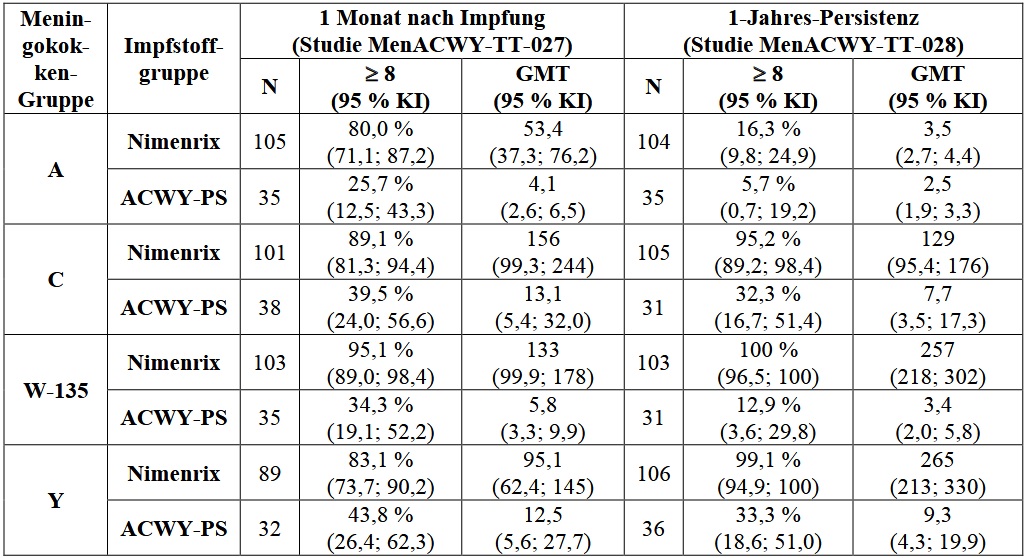
Die Persistenz der Immunantwort wurde anhand von hSBA bis zu 5 Jahre nach der Impfung von Jugendlichen und Erwachsenen untersucht, die ursprünglich in der Studie MenACWY-TT-052 geimpft worden waren (Tabelle 13) (siehe Abschnitt 4.4).
Tabelle 13: Daten 1 Monat nach der Impfung (Studie MenACWY-TT-052) und 5-Jahres-Persistenzdaten (hSBA*, Studie MenACWY-TT-059) bei Jugendlichen und
Erwachsenen im Alter von 11 bis 25 Jahren
Die Immunogenitätsanalyse wurde in der für jeden Zeitpunkt angepassten ATP-Kohorte für Persistenz durchgeführt.
* in GSK-Laboratorien getestet
In einer weiteren Studie (MenACWY-TT-085) wurde eine Einzeldosis Nimenrix 194 libanesischen Erwachsenen im Alter von 56 Jahren und älter verabreicht (dazu gehörten 133 Personen im Alter von 56 bis 65 Jahren und 61 Personen im Alter von über 65 Jahren). Der Anteil an Personen mit rSBA-Titern (in Laboratorien von GSK gemessen) von ≥ 128 lag vor der Impfung zwischen 45 % (Gruppe C) und 62 % (Gruppe Y). Insgesamt lag einen Monat nach der Impfung der Anteil an Geimpften mit rSBA-Titern von ≥ 128 zwischen 93 % (Gruppe C) und 97 % (Gruppe Y). In der Altersgruppe der über 65-Jährigen lag einen Monat nach der Impfung der Anteil an Geimpften mit rSBA-Titern ≥ 128 zwischen 90 % (Gruppe A) und 97 % (Gruppe Y).
Antwort auf eine Auffrischimpfung bei Probanden, die zuvor mit einem Meningokokken-Konjugatimpfstoff gegen Neisseria meningitidis geimpft worden waren
Die Auffrischimpfung mit Nimenrix bei Personen, die zuvor eine Grundimmunisierung mit einem monovalenten (MenC-CRM) oder einem quadrivalenten Meningokokken-Konjugatimpfstoff (MenACWY-TT) erhalten hatten, wurde bei Personen ab einem Alter von 12 Monaten, die eine Auffrischimpfung erhielten, untersucht. Es wurde jeweils ein robustes Immungedächtnis in Bezug auf das/die Antigen(e) beobachtet, die im zur Grundimmunisierung verwendeten Impfstoff enthalten waren.
Antwort auf Nimenrix bei Probanden, die zuvor mit einem einfachen Polysaccharid-Impfstoff gegen Neisseria meningitidis geimpft worden waren
In der bei Probanden im Alter von 4,5 bis 34 Jahren durchgeführten Studie MenACWY-TT-021 wurde die Immunogenität einer Impfung mit Nimenrix, die zwischen 30 und 42 Monaten nach der Impfung mit einem ACWY-PS-Impfstoff vorgenommen wurde, mit der Immunogenität von Probanden im
gleichen Alter verglichen, die in den vergangenen zehn Jahren keinen Meningokokken-Impfstoff erhalten haben. Bei allen Probanden wurde, unabhängig vom Meningokokken-Impfstatus, eine Immunantwort (rSBA-Titer ≥ 8) auf alle Gruppen (A, C, W-135, Y) beobachtet. Bei Personen, die 30-42 Monate vor Nimenrix eine Dosis des ACWY-PS-Impfstoffes erhalten hatten, waren die rSBA-GMTs signifikant niedriger, jedoch erreichten 100 % der Personen rSBA-Titer ≥ 8 für alle
4 Meningokokken-Gruppen (A, C, W-135, Y) (siehe Abschnitt 4.4).
Kinder (2 bis 17 Jahre) mit anatomischer oder funktioneller Asplenie
In der Studie MenACWY-TT-084 wurden die Immunantworten von 43 Probanden mit anatomischer
oder funktioneller Asplenie im Alter von 2 bis 17 Jahren nach zwei Dosen Nimenrix, verabreicht im
Abstand von 2 Monaten, mit denen von 43 Probanden im gleichen Alter mit normaler Milzfunktion
verglichen. Einen Monat nach der ersten Impfdosis und einen Monat nach der zweiten Impfdosis
erreichte ein etwa gleichgroßer Anteil der Probanden rSBA-Titer ≥ 1:8 und ≥ 1:128 und hSBA-Titer
≥ 1:4 und ≥ 1:8.
5.2 Pharmakokinetische Eigenschaften
Nicht zutreffend.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den Studien zur lokalen Verträglichkeit, akuten Toxizität, Toxizität bei wiederholter Gabe, Entwicklungs-/ Reproduktionstoxizität und Fertilität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Pulver:
Saccharose
Trometamol
Lösungsmittel:
Natriumchlorid
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden
6.3 Dauer der Haltbarkeit
4 Jahre
Nach Rekonstitution:
Nach der Rekonstitution sollte der Impfstoff sofort verwendet werden. Obwohl eine verzögerte Verwendung nicht empfohlen wird, konnte für den gelösten Impfstoff eine Stabilität für 8 Stunden bei 30°C gezeigt werden. Nach Ablauf dieser 8 Stunden darf der rekonstituierte Impfstoff nicht mehr verabreicht werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2°C – 8°C).
Nicht einfrieren.
In der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Aufbewahrungsbedingungen nach Rekonstitution des Arzneimittels, siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Pulver in einer Durchstechflasche (Glas Typ I) mit einem Stopfen (Butylgummi) und Lösungsmittel in einer Fertigspritze mit einem Stopfen (Butylgummi).
Packungsgrößen zu 1 und 10 mit oder ohne Nadeln/ Kanülen.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Anleitung für die Rekonstitution des Impfstoffes mit dem Lösungsmittel in einer Fertigspritze
Nimenrix wird rekonstituiert, indem man der Durchstechflasche mit dem darin enthaltenen Pulver den gesamten Inhalt der Fertigspritze zusetzt.
Um die Nadel an der Spritze zu befestigen, siehe bitte untenstehendes Bild. Die mit Nimenrix zur Verfügung gestellte Spritze kann sich jedoch etwas von der im Bild beschriebenen Spritze unterscheiden (ohne Schraubgewinde). In diesem Fall sollte die Nadel ohne Verschrauben befestigt werden.

Der rekonstituierte Impfstoff ist eine klare, farblose Lösung.
Der rekonstituierte Impfstoff ist vor der Verabreichung per Augenschein auf Fremdpartikel und/ oder physikalische Veränderungen zu untersuchen. Falls solche beobachtet werden, ist der Impfstoff zu verwerfen.
Nach der Rekonstitution sollte der Impfstoff sofort verwendet werden.
Zur Verabreichung des Impfstoffes sollte eine neue Nadel/ Kanüle verwendet werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen
zu beseitigen.
7. INHABER DER ZULASSUNG
Pfizer Europe MA EEIG
Boulevard de la Plaine 17
1050 Brüssel
Belgien
8. ZULASSUNGSNUMMER(N)
EU/1/12/767/001
EU/1/12/767/002
EU/1/12/767/003
EU/1/12/767/004
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 20. April 2012
Datum der letzten Verlängerung der Zulassung: 16. Februar 2017
10. STAND DER INFORMATION
Dezember 2018
spcde-9v9nx-pvl-0 20 16.01.2019
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen
Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar.
VERKAUFSABGRENZUNG IN DEUTSCHLAND
Verschreibungspflichtig
REZEPTPFLICHT/APOTHEKENPFLICHT IN ÖSTERREICH
Rezept- und apothekenpflichtig, wiederholte Abgabe verboten
PACKUNGSGRÖSSEN IN DEUTSCHLAND
1 Durchstechflasche mit Pulver und 1 Fertigspritze mit Lösungsmittel (ohne Nadel) N1
10 Durchstechflaschen mit Pulver und 10 Fertigspritzen mit Lösungsmittel (ohne Nadeln)
PACKUNGSGRÖSSEN IN ÖSTERREICH
1 Durchstechflasche mit Pulver und 1 Fertigspritze mit Lösungsmittel (mit 2 Nadeln)
REPRÄSENTANT IN DEUTSCHLAND PFIZER PHARMA GmbH
Linkstr. 10
10785 Berlin
Tel.: 030 550055-51000
Fax: 030 550054-10000
REPRÄSENTANT IN ÖSTERREICH
Pfizer Corporation Austria Ges.m.b.H.
Floridsdorfer Hauptstraße 1
A-1210 Wien
Tel.: +43 (0)1 521 15-0
Quelle: Sozialministerium