Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
VIMKUNYA Injektionssuspension in einer Fertigspritze Chikungunya-Impfstoff (rekombinant, adsorbiert)
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Dosis (0,8 ml) enthält 40 Mikrogramm Protein von virusähnlichen Partikeln1, 2 (virus-like particles, VLP) des Chikungunya-Virus (CHIKV), adsorbiert an wasserhaltigem Aluminiumhydroxid.
1mittels rekombinanter DNA-Technologie in humanen embryonalen Nierenzellen produziert. 2gewonnen aus dem CHIKV-Stamm 37997 aus dem Senegal, bestehend aus dem CHIKV- Kapsidprotein (C) und den Hüllproteinen E1 und E2.
Wasserhaltiges Aluminiumhydroxid (ca. 300 Mikrogramm Al3+ pro 0,8-ml-Dosis).
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionssuspension.
Vor dem Schütteln ist der Impfstoff eine klare Flüssigkeit mit weißem Niederschlag.
pH: 6,6-8,2
Osmolalität: 320-390 mOsmol/kg
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
VIMKUNYA wird angewendet bei Personen ab 12 Jahren für die aktive Immunisierung zur Prävention einer Erkrankung, die durch das Chikungunya-Virus (CHIKV) verursacht wird.
Die Anwendung dieses Impfstoffs soll nach den offiziellen Empfehlungen erfolgen.
4.2 Dosierung und Art der Anwendung
Dosierung
Es wird eine Einzeldosis von 0,8 ml verabreicht.
Ältere Personen
Eine Dosisanpassung bei älteren Personen ≥ 65 Jahren ist nicht erforderlic
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von VIMKUNYA bei Kindern im Alter von unter 12 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Art der Anwendung
Der Impfstoff ist als intramuskuläre (i.m.) Injektion in den Deltamuskel zu verabreichen.
VIMKUNYA darf nicht intravenös, intradermal oder subkutan injiziert werden.
Die Fertigspritze ist unmittelbar vor Gebrauch kräftig zu schütteln, um eine homogene Suspension zu erhalten.
Hinweise zur Handhabung und zur Entsorgung von Abfallmaterialien, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Rückverfolgbarkeit
Um die Rückverfolgbarkeit biologischer Arzneimittel zu verbessern, müssen die Bezeichnung des Arzneimittels und die Chargenbezeichnung des angewendeten Arzneimittels eindeutig dokumentiert werden.
Überempfindlichkeit und Anaphylaxie
Für den Fall, dass nach der Verabreichung von VIMKUNYA eine akute anaphylaktische Reaktion auftritt, muss eine angemessene medizinische Behandlung zur Bewältigung unmittelbarer allergischer Reaktionen sofort verfügbar sein.
Immungeschwächte Personen
Die Sicherheit und Wirksamkeit von VIMKUNYA wurden bei immungeschwächten Patienten und Patienten unter systemischer immunsuppressiver Therapie nicht untersucht. Es ist nicht bekannt, ob Personen mit eingeschränkter Immunreaktivität, einschließlich Personen, die eine immunsuppressive Therapie erhalten, eine vergleichbare Immunantwort auf die Impfung aufweisen wie immunkompetente Personen.
Angstbedingte Reaktionen
Wie bei allen injizierbaren Impfstoffen können im Zusammenhang mit der Impfung angstbedingte Reaktionen, einschließlich vasovagaler Reaktionen (Synkopen), Hyperventilation oder stressbedingter Reaktionen, als psychogene Reaktion auf die Injektion mit der Nadel auftreten. Es ist wichtig, im Vorfeld Vorsichtsmaßnahmen zu ergreifen, um Verletzungen durch Ohnmacht vorzubeugen.
Gleichzeitige Erkrankungen
Die Impfung ist bei Personen zu verschieben, die an einer akuten schweren fiebrigen Erkrankung oder einer akuten Infektion leiden. Das Vorliegen einer geringfügigen Infektion und/oder eines leichten Fiebers ist kein Grund für ein Verschieben der Impfung.
Thrombozytopenie und Gerinnungsstörungen
Wie bei anderen intramuskulären Injektionen ist der Impfstoff bei Personen, die eine Therapie mit Antikoagulantien erhalten, oder bei Personen mit Thrombozytopenie oder einer Gerinnungsstörung (z. B. Hämophilie) mit Vorsicht zu verabreichen, da bei diesen Personen nach einer intramuskulären Injektion Blutungen oder Blutergüsse auftreten können.
Einschränkung der Wirksamkeit des Impfstoffs
Wie bei allen Impfstoffen schützt die Impfung möglicherweise nicht alle geimpften Personen. Es wird empfohlen, nach der Impfung weiterhin persönliche Schutzmaßnahmen gegen Mückenstiche zu ergreifen.
Sonstige Bestandteile
Kalium
Dieser Impfstoff enthält Kalium, jedoch weniger als 1 mmol (39 mg) Kalium pro Dosis, d. h. er ist nahezu „kaliumfrei“.
Natrium
Dieser Impfstoff enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h. er ist nahezu „natriumfrei“.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen mit anderen Arzneimitteln durchgeführt.
Die gleichzeitige Verabreichung von VIMKUNYA mit anderen Impfstoffen wurde nicht untersucht.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
In tierexperimentellen Studien wurden bei Ratten und Kaninchen keine impfstoffbedingten unerwünschten Wirkungen auf die embryofetale Entwicklung beobachtet; einige postnatale Wirkungen von unbekannter klinischer Relevanz wurden nur bei Kaninchen beobachtet (siehe Abschnitt 5.3).
Bisher liegen nur sehr begrenzte Erfahrungen mit der Anwendung von VIMKUNYA bei Schwangeren vor. Die vorliegenden Daten reichen nicht aus, um zu dem Schluss zu gelangen, dass VIMKUNYA keine potenziellen Auswirkungen auf die Schwangerschaft, die embryofetale Entwicklung, die Geburt und die postnatale Entwicklung hat.
Bei der Abwägung der Verabreichung von VIMKUNYA während der Schwangerschaft sind das individuelle Risiko einer Exposition gegenüber dem CHIKV-Wildtyp, das Gestationsalter und die Risiken für den Fötus oder das Neugeborene zu berücksichtigen.
Stillzeit
Es ist nicht bekannt, ob VIMKUNYA in die Muttermilch übergeht. Ein Risiko für das gestillte Kind kann nicht ausgeschlossen werden. Die Vorteile des Stillens für die Entwicklung und die Gesundheit sollten zusammen mit der klinischen Notwendigkeit von VIMKUNYA für die Mutter und den möglichen negativen Auswirkungen von VIMKUNYA auf das gestillte Kind berücksichtigt werden.
Fertilität
Es wurden keine spezifischen Studien zur Fertilität durchgeführt.
Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche Wirkungen in Bezug auf die weibliche Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Jedoch können einige der in Abschnitt 4.8 „Nebenwirkungen“ aufgeführten Wirkungen die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen vorübergehend beeinträchtigen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die häufigste lokale Nebenwirkung an der Injektionsstelle nach Verabreichung des Impfstoffs waren Schmerzen an der Injektionsstelle (24,0 %). Die häufigsten systemischen Nebenwirkungen nach der Impfung waren Ermüdung/Fatigue (17,8 %), Kopfschmerzen (16,7 %) und Myalgie (16,5 %) (Tabelle 1).
Tabellarische Liste der Nebenwirkungen
Die tabellarische Zusammenfassung der Nebenwirkungen nach Verabreichung von VIMKUNYA (Tabelle 1) basiert auf einer Analyse der gepoolten Sicherheitsdaten aus drei abgeschlossenen Phase-II-Studien und zwei abgeschlossenen Phase-III-Studien mit 3 522 Teilnehmenden im Alter von ≥ 12 Jahren, die VIMKUNYA erhielten. Von diesen erhielten 3 141 Personen eine Einzeldosis von
40 Mikrogramm VIMKUNYA. Diese Teilnehmenden wurden während des gesamten Studienzeitraums von 182 Tagen auf schwerwiegende Nebenwirkungen hin nachbeobachtet.
Die Nebenwirkungen werden als bevorzugte Begriffe (Preferred Terms) nach MedDRA unter der MedDRA-Systemorganklasse dargestellt. Die gemeldeten Nebenwirkungen sind nach den folgenden Häufigkeiten aufgelistet:
- Sehr häufig ≥ 1/10
- Häufig ≥ 1/100, < 1/10
- Gelegentlich ≥ 1/1 000, < 1/100
- Selten ≥ 1/10 000, < 1/1 000
- Sehr selten < 1/10 000
Tabelle 1: Nach der Verabreichung von VIMKUNYA gemeldete Nebenwirkungen
| Systemorganklasse gemäß MedDRA | Nebenwirkungen | Häufigkeit |
|---|---|---|
| Allgemeine Erkrankungen und Beschwerden am Verabreichungsort | Schmerzen an der Injektionsstelle | Sehr häufig |
| Ermüdung/Fatigue | Sehr häufig | |
| Schüttelfrost | Häufig | |
| Unwohlsein | Häufig | |
| Rötung an der Injektionsstelle | Gelegentlich | |
| Schwellung an der Injektionsstelle | Gelegentlich | |
| Fieber | Gelegentlich | |
| Blauer Fleck an der Injektionsstelle | Gelegentlich | |
| Erkrankungen des Nervensystems | Kopfschmerzen | Sehr häufig |
| Schwindelgefühl | Gelegentlich | |
| Parästhesie | Selten | |
| Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen | Myalgie | Sehr häufig |
| Arthralgie | Häufig | |
| Schmerz in einer Extremität | Selten | |
| Erkrankungen des Gastrointestinaltrakts | Übelkeit | Häufig |
| Diarrhö | Selten | |
| Lippe geschwollen | Selten | |
| Erkrankungen des Blutes und des Lymphsystems | Lymphadenopathie | Selten |
| Infektionen und parasitäre Erkrankungen | Gastroenteritis | Selten |
| Erkrankung der Atemwege, des Brustraums und Mediastinums | Nasenverstopfung | Gelegentlich |
| Schmerzen im Oropharynx | Selten | |
| Rhinorrhö | Selten | |
| Erkrankungen der Haut und des Unterhautgewebes | Ausschlag | Gelegentlich |
Jugendliche
Von den 3 522 Teilnehmenden der klinischen Studien, denen VIMKUNYA verabreicht wurde, waren 6,2 % (N = 217) in einem Alter zwischen 12 und < 18 Jahren; sie erhielten eine Dosis von
40 Mikrogramm VIMKUNYA und wurden 182 Tage nachbeobachtet. Das Sicherheitsprofil bei Jugendlichen ähnelt dem allgemeinen Sicherheitsprofil bei Erwachsenen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das in Anhang V aufgeführte nationale Meldesystem anzuzeigen.
4.9 Überdosierung
In den klinischen Studien wurde kein Fall von Überdosierung berichtet. Im Fall einer Überdosierung wird die Überwachung der Vitalparameter und gegebenenfalls eine symptomatische Behandlung empfohlen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere virale Impfstoffe, ATC-Code: Noch nicht zugewiesen
Wirkmechanismus
Bei VIMKUNYA handelt es sich um einen rekombinanten Protein-Impfstoff aus VLP mit Adjuvans. VLP können keine Zellen infizieren, können nicht reproduzieren oder Krankheiten auslösen. Der genaue Wirkmechanismus des Schutzes gegen eine CHIKV-Infektion und/oder -Erkrankung wurde nicht bestimmt. Man geht davon aus, dass VIMKUNYA einen Schutz vor einer CHIKV-Infektion bewirken kann, indem es die Bildung neutralisierender Antikörper gegen die in VIMKUNYA enthaltenen CHIKV-Proteine C, E1 und E2 induziert, was zur Neutralisierung des Lebendvirus führt. Ein Adjuvans wird hinzugegeben, um das Ausmaß der durch den Impfstoff vermittelten Immunreaktion zu erhöhen.
Immunogenität
Es liegen keine Wirksamkeitsdaten für VIMKUNYA vor. Die klinische Wirksamkeit wurde aus dem Schwellenwert eines CHIKV-spezifischen neutralisierenden Antikörpertiters nach der Impfung abgeleitet.
Als Surrogatmarker für die Vorhersage des Schutzes vor durch CHIKV ausgelösten Erkrankungen wurde ein Schwellenwert von ≥ 100 für den Titer der neutralisierenden CHIKV-Serumantikörper
(serum neutralising antibody, SNA) gewählt, der eine 80%ige Neutralisierung von CHIKV, gemessen mit einem In-vitro-Neutralisationstest, gewährleistet, was als Seroresponse bezeichnet wird. Dieser Schwellenwert wurde auf der Grundlage einer prospektiven seroepidemiologischen Studie an
Personen mit früherer Exposition gegenüber CHIKV und einer passiven Transfer-/Challenge-Studie an nichtmenschlichen Primaten (non-human primates, NHP) unter Verwendung gepoolter Seren von Teilnehmenden, die mit dem VIMKUNYA-Impfstoff geimpft wurden, ermittelt.
Die Immunogenität einer Einzeldosis von 40 Mikrogramm VIMKUNYA wurde in zwei in den USA durchgeführten Zulassungsstudien untersucht, einer klinischen Studie der Phase III an Jugendlichen und Erwachsenen im Alter von 12 bis < 65 Jahren (Studie 1) und einer klinischen Studie der Phase III an Erwachsenen ≥ 65 Jahren (Studie 2). Die Teilnehmenden beider Phase-III-Studien wurden nach der Impfung über einen Zeitraum von 6 Monaten nachbeobachtet. Co-primäre Endpunkte waren sowohl die Differenz in der Anti-CHIKV-SNA-Seroresponse-Rate (Differenz zwischen VIMKUNYA- Impfstoff und Placebo) als auch in den geometrischen Mittelwerten der Anti-CHIKV-SNA-Titer (GMT) 21 Tage nach der Impfung (Studienbesuchstag 22). Die Seroresponse-Rate (SRR) wurde definiert als der Prozentsatz der Personen, die einen Anti-CHIKV-SNA-NT80-Titer ≥ 100 aufwiesen. Immunsupprimierte Personen und Personen, die in den letzten 6 Monaten vor dem Screening Immunsuppressiva eingenommen hatten, waren von der Teilnahme an der Studie ausgeschlossen.
Studie 1
Bei dieser Studie handelte es sich um eine zulassungsrelevante, randomisierte, multizentrische, placebokontrollierte, doppelblinde, klinische Parallelgruppenstudie der Phase III, durchgeführt in den USA. Insgesamt 3 258 gesunde Teilnehmende im Alter zwischen 12 und < 65 Jahren (Durchschnittsalter 39 Jahre [Spanne 12 bis 64]) wurden in einem Verhältnis von 2 : 2 : 2 : 1 innerhalb jeder Altersschicht (12 bis < 18 [N = 254; 7,8 %], 18 bis < 46 [N = 1 906; 58,5 %] und 46 bis
< 65 Jahre [N = 1 098; 33,7 %]) randomisiert, um entweder eine von drei aufeinanderfolgend hergestellten Chargen von VIMKUNYA als intramuskuläre Einzeldosis von 40 Mikrogramm in einer Fertigspritze oder Placebo zu erhalten. Von der randomisierten Population waren 1 591 (48,8 %) männlich und 1 667 (51,2 %) weiblich. Zu Studienbeginn waren 69 Teilnehmende seropositiv
(definiert als Anti-CHIKV-Titer ≥ 15 [≥ untere Bestimmungsgrenze (lower limit of quantitation, LLOQ)] an Tag 1 vor Dosisgabe), davon 63 Teilnehmende in der VIMKUNYA-Gruppe und 6 in der Placebogruppe.
Es wurde die Immunantwort von 2 559 Teilnehmenden (bezüglich Immunogenität auswertbare Population [immunogenicity evaluable population, IEP]), die VIMKUNYA erhielten, und von
424 Teilnehmenden, die Placebo erhielten, analysiert. Alle Teilnehmende der IEP waren bei Studienbeginn (vor der Impfung) seronegativ in Bezug auf neutralisierende CHIKV-Antikörper. Der Vergleich der Anti-CHIKV-SNA-Reaktion auf VIMKUNYA und Placebo an den
Studienbesuchstagen 8, 15, 22 und 183, gemessen als klinisch relevanter Unterschied in Seroresponse- Rate und GMT, ist in Tabelle 2 und Tabelle 3 dargestellt.
Tabelle 2: Anti-CHIKV-SNA-Seroresponse-Rate (SRR) an den Besuchstagen 8, 15, 22 und 183 für die Phase-III-Studie 1 (12 bis < 65 Jahre) (bezüglich Immunogenität auswertbare Population)
| Studientag | SRR VIMKUNYA (N = 2 559) n/N (%)(a) [95%-KI]b | SRR Placebo (N = 424) n/N (%)a [95%-KI](b) | SRR-Differenz [95%-KI](c) | p-Wert(d) |
|---|---|---|---|---|
| Tag 8 | 1 169/2 510 (46,6 %) [44,6 %, 48,5 %] | 2/419 (0,5 %) [0,1 %, 1,7 %] | 46,1 % [43,8 %, 48,1 %] | |
| Tag 15 | 355/2 434 (96,8 %) [96,0 %, 97,4 %] | 3/395 (0,8 %) [0,3 %, 2,2 %] | 96,0 % [94,3 %, 96,8 %] | |
| Tag 22 | 2 503/2 559 (97,8 %) [97,2 %, 98,3 %] | 5/424 (1,2 %) [0,5 %, 2,7 %] | 96,6 % [95,0 %, 97,5 %] | |
| Tag 183 | 1 967/2 301 (85,5 %) [84,0 %, 86,9 %] | 6/401 (1,5 %) [0,7 %, 3,2 %] | 84,0 % [81,7 %, 85,6 %] |
KI = Konfidenzintervall; SNA = neutralisierende Serumantikörper, SRR = Seroresponse-Rate.
a n ist die Anzahl der Teilnehmenden mit Seroresponse ≥ einem Titer zu 100, dividiert durch N, der Gesamtzahl
der Teilnehmenden in der Gruppe.
b Die 95%-KI der Seroresponse-Raten basieren auf der Wilson-Methode.
c Die Differenz der Seroresponse-Raten entspricht (Differenz aus VIMKUNYA abzüglich Placebo); die 95%-KI basieren auf der Hybrid-Score-Methode von Newcombe. Statistische Überlegenheit gegenüber Placebo und untere Grenze des zweiseitigen 95%-KI für die Differenz in den Seroresponse-Raten zwischen der VIMKUNYA-Gruppe und der Placebogruppe ≥ 70 % (gilt als klinisch signifikant).
d Der p-Wert ergibt sich aus einem zweiseitigen Chi-Quadrat-Test auf Gleichheit der Seroresponse-Prozentsätze
zwischen den Gruppen.
| Studientag | VIMKUNYA (N = 2 559) | Placebo (N = 424) | p-Wertc |
|---|---|---|---|
| Tag 8(a) | |||
| n(b) | 2 510 | 419 | |
| SNA GMT [95%-KI] | 93,4 [87,2, 100,0] | 7,4 [6,5, 8,4] | |
| Tag 15(a) | |||
| n(b) | 2 434 | 395 | |
| SNA GMT [95%-KI] | 1 095,8 [1 029,3, 1 166,7] | 7,6 [6,8, 8,6] | |
| Tag 22(a) | |||
| n(b) | 2 559 | 424 | |
| SNA GMT [95%-KI] | 1 618,1 [1 522,1, 1 720,0] | 7,9 [7,0, 8,8] | |
| Tag 183(a) | |||
| n(b) | 2 301 | 401 | |
| SNA GMT [95%-KI] | 337,7 [318,3, 358,4] | 8,2 [7,3, 9,1] |
GMT = geometrischer Mittelwert der Titer, IEP = bezüglich Immunogenität auswertbare Population, N = Gesamt-IEP, SNA = neutralisierende Serumantikörper.
Bei den GMT-Ergebnissen wurde den Werten unterhalb der unteren Bestimmungsgrenze (LLOQ) von 15 der Wert LLOQ/2 = 7,5 zugeordnet.
IEP: exponierte Teilnehmende, die an Tag 1 keine messbaren Anti-CHIKV-SNA aufweisen, an Tag 22 ein Ergebnis einer auswertbaren Serumprobe innerhalb des Analysefensters (Tag 19 bis einschließlich 27) haben und keine zum Ausschluss führenden Prüfplanabweichungen aufweisen, wie der Bestimmung vor Datenbanksperre oder der Entblindung (je nach Fall).
a Tage 8, 15, 22 und 183, was 7, 14, 21 bzw. 182 Tagen nach der Impfung mit VIMKUNYA entspricht.
b n ist die Anzahl der Teilnehmenden, bei denen zum angegebenen Besuchstermin ein Probenergebnis vorliegt.
c Die Schätzungen der geometrischen Mittelwerte der Titer sowie deren 95%-KI wurden aus einem ANOVA- Modell abgeleitet, das das Prüfzentrum und die Behandlungsgruppe als feste Effekte einschließt, wobei Normalität des Logarithmus der Titer angenommen wurde. Das Verhältnis von GMT und die 95%-KI werden
aus demselben Modell abgeleitet. Der p-Wert testet die Äquivalenz der Gruppen-GMT auf der logarithmischen Skala (d. h., das GMT-Verhältnis entspricht 1).
d Nominaler p-Wert (formale Anpassungen für Mehrfachvergleiche wurden nicht vorgenommen).
Studie 2
Bei dieser Studie handelte es sich um eine randomisierte, placebokontrollierte, doppelblinde Parallelgruppenstudie der Phase III mit zwei Behandlungsgruppen (VIMKUNYA oder Placebo). Es war eine multizentrische Studie in den USA, an der 413 gesunde Teilnehmende im Alter von ≥ 65 Jahren teilnahmen. Die Teilnehmenden wurden in einem Verhältnis von 1:1 randomisiert und erhielten entweder eine Einzeldosis von 40 Mikrogramm VIMKUNYA oder Placebo. Die Zielpopulation waren Erwachsene ≥ 65 Jahre (Durchschnittsalter 71 Jahre [Spanne 65 bis 95]), stratifiziert nach Altersuntergruppen (65 bis < 75 Jahre [N = 318; 77 %] und ≥ 75 Jahre [N = 95;
23 %]). Von der randomisierten Population waren 171 (41 %) männlich und 242 (59 %) weiblich. Die Teilnehmende dieser Studie wurden nach der Immunisierung über einen Zeitraum von 6 Monaten nachbeobachtet. Zu Studienbeginn waren 15 Teilnehmende seropositiv (definiert als Anti-CHIKV- Titer ≥ 15 [≥ untere Bestimmungsgrenze (lower limit of quantitation, LLOQ)] an Tag 1 vor Dosisgabe), davon 5 Teilnehmende in der VIMKUNYA-Gruppe und 10 in der Placebogruppe. Die bezüglich Immunogenität auswertbare Population umfasste 372 Teilnehmende, von denen
189 Teilnehmende VIMKUNYA und 183 Teilnehmende Placebo erhielten. Alle diese Teilnehmenden waren bei Studienbeginn (vor der Impfung) negativ in Bezug auf neutralisierende CHIKV-Antikörper.
Der Vergleich der Anti-CHIKV-SNA-Reaktion auf VIMKUNYA und Placebo an den Studienbesuchstagen 15, 22 und 183, gemessen als klinisch relevanter Unterschied in Seroresponse- Rate und GMT, ist in Tabelle 4 und Tabelle 5 dargestellt.
Tabelle 4: Anti-CHIKV-SNA-Seroresponse-Rate (SRR) an den Besuchstagen 15, 22 und 183 für die Phase-III-Studie 2 (≥ 65 Jahre) (bezüglich Immunogenität auswertbare Population)
| Studientag | SRR VIMKUNYA (N = 189) n/N (%)()a [95%-KI](b) | SRR Placebo (N = 183) n/N (%)(a) [95%-KI](b) | SRR-Differenz [95%-KI](c) | p-Wert(d) |
|---|---|---|---|---|
| Tag 15 | 149/181 (82,3 %) [76,1 %, 87,2 %] | 5/176 (2,8 %) [1,2 %, 6,5 %] | 79,5 % [72,3 %, 84,6 %] | |
| Tag 22 | 165/189 (87,3 %) [81,8 %, 91,3 %] | 2/183 (1,1 %) [0,3 %, 3,9 %] | 86,2 % [80,0 %, 90,3 %] | |
| Tag 183 | 139/184 (75,5 %) [68,9 %, 81,2 %] | 2/173 (1,2 %) [0,3 %, 4,1 %] | 74,4 % [67,1 %, 80,1 %] |
KI = Konfidenzintervall; SNA = neutralisierende Serumantikörper, SRR = Seroresponse-Rate.
b n ist die Anzahl der Teilnehmenden mit Seroresponse ≥ einem Titer zu 100, dividiert durch N, der Gesamtzahl
der Teilnehmenden in der Gruppe.
b Die 95%-KI der Seroresponse-Raten basieren auf der Wilson-Methode.
c Die Differenz der Seroresponse-Raten entspricht (Differenz aus VIMKUNYA abzüglich Placebo); die 95%-KI basieren auf der Hybrid-Score-Methode von Newcombe. Statistische Überlegenheit gegenüber Placebo und untere Grenze des zweiseitigen 95%-KI für die Differenz in den Seroresponse-Raten zwischen der VIMKUNYA-Gruppe und der Placebogruppe ≥ 70 % (gilt als klinisch signifikant).
d Der p-Wert ergibt sich aus einem zweiseitigen Chi-Quadrat-Test auf Gleichheit der Seroresponse-Prozentsätze zwischen den Gruppen.
Tabelle 5: Geometrischer Mittelwert der Anti-CHIKV-SNA-Titer (GMT) an den Besuchstagen 15, 22 und 183 für die Phase-III-Studie 2 (≥ 65 Jahre) (bezüglich Immunogenität auswertbare Population)
| Studientag | VIMKUNYA (N = 189) | Placebo (N = 183) | p-Wert(c) |
|---|---|---|---|
| Tag 15(a) | |||
| n(b) | 181 | 176 | |
| SNA GMT [95%-KI] | 378,4 [301,0, 475,7] | 9,0 [7,1, 11,3] | |
| Tag 22(a) | |||
| n(b) | 189 | 183 | |
| SNA GMT [95%-KI] | 723,9 [584,1, 897,2] | 8,1 [6,5, 10,0] | |
| Tag 183(a) | |||
| n(b) | 184 | 173 | |
| SNA GMT [95%-KI] | 233,0 [194,1, 279,8] | 8,3 [6,9, 10,0] |
GMT = geometrischer Mittelwert der Titer, IEP = bezüglich Immunogenität auswertbare Population, N = Gesamt-IEP, SNA = neutralisierende Serumantikörper.
Bei den GMT-Ergebnissen wurde den Werten unterhalb der unteren Bestimmungsgrenze (LLOQ) von 15 der Wert LLOQ/2 = 7,5 zugeordnet.
IEP: exponierte Teilnehmende, die an Tag 1 keine messbaren Anti-CHIKV-SNA aufweisen, an Tag 22 ein Ergebnis einer auswertbaren Serumprobe innerhalb des Analysefensters (Tag 19 bis einschließlich 27) haben und keine zum Ausschluss führenden Prüfplanabweichungen aufweisen, wie der Bestimmung vor Datenbanksperre oder der Entblindung (je nach Fall).
a Tage 15, 22 und 183, was 14, 21 bzw. 182 Tagen nach der Impfung mit VIMKUNYA entspricht.
b n ist die Anzahl der Teilnehmenden, bei denen zum angegebenen Besuchstermin ein Probenergebnis vorliegt.
c Die Schätzungen der geometrischen Mittelwerte der Titer sowie deren 95%-KI wurden aus einem ANOVA- Modell abgeleitet, das das Prüfzentrum und die Behandlungsgruppe als feste Effekte einschließt, wobei Normalität des Logarithmus der Titer angenommen wurde. Das Verhältnis von GMT und die 95%-KI werden
aus demselben Modell abgeleitet. Der p-Wert testet die Äquivalenz der Gruppen-GMT auf der logarithmischen Skala (d. h., das GMT-Verhältnis entspricht 1).
d Nominaler p-Wert (formale Anpassungen für Mehrfachvergleiche wurden nicht vorgenommen).
In den Phase-III-Studien (Studie 1, Studie 2) wurden in der VIMKUNYA-Gruppe an Tag 22 (21 Tage nach der Impfung) in den verschiedenen Altersgruppen die folgende Seroresponse-Rate (Anti- CHIKV-SNA-NT80-Titer ≥ 100) und GMT gemessen: 12 bis < 18: 97,0 %, GMT 2 502; 18 bis < 46: 98,3 %, GMT 1 878; 46 bis < 65: 97,2 %, GMT 1 175; ≥ 65 bis < 75: 87,9 %, GMT 726; und ≥ 75 Jahre: 85,0 %, GMT 716.
Kinder und Jugendliche
Die Europäische Arzneimittel-Agentur hat für VIMKUNYA eine Zurückstellung von der Verpflichtung zur Vorlage von Ergebnissen zu Studien in einer oder mehreren pädiatrischen Altersklassen im Rahmen der aktiven Immunisierung zur Vorbeugung von Krankheiten, die durch das Chikungunya-Virus (CHIKV) verursacht werden, gewährt (siehe Abschnitt 4.2 bzgl. Informationen zur Anwendung bei Kindern und Jugendlichen).
5.2 Pharmakokinetische Eigenschaften
Nicht zutreffend.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Toxizität bei wiederholter Gabe und lokalen Verträglichkeit lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
Reproduktionstoxizität
Studien zur Entwicklungs- und Reproduktionstoxizität wurden an weiblichen Kaninchen und Ratten durchgeführt, denen vor der Paarung und während der Trächtigkeit mehrere Dosen von VIMKUNYA verabreicht wurden. Bei keiner Spezies wurden impfstoffbedingte unerwünschte Wirkungen auf die weibliche Fruchtbarkeit oder die embryofetale Entwicklung beobachtet. Ein Rückgang des postnatalen Überlebensindexes wurde bei Kaninchen, nicht aber bei Ratten beobachtet; die Relevanz dieses Ergebnisses für den Menschen ist nicht bekannt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
- Saccharose
- Kaliummonohydrogenphosphat (Ph.Eur.)
- Kaliumdihydrogenphosphat
- Natriumcitrat
- Wasser für Injektionszwecke
Für das Adsorbens siehe Abschnitt 2.
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieser Impfstoff nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C – 8 °C).
Nicht einfrieren.
Die Spritze im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Daten zur Stabilität deuten darauf hin, dass die Bestandteile des Impfstoffs bei einer Lagerung bei 8 °C bis 25 °C für 4 Stunden und bei einer Lagerung bei 0 °C bis 2 °C für mindestens 24 Stunden stabil ist. Nach Ablauf dieses Zeitraums ist VIMKUNYA sofort zu verwenden oder zu verwerfen. Diese Daten dienen nur im Falle einer vorübergehenden Temperaturabweichung als Orientierungshilfe für medizinisches Fachpersonal.
6.5 Art und Inhalt des Behältnisses
Art des Behältnisses
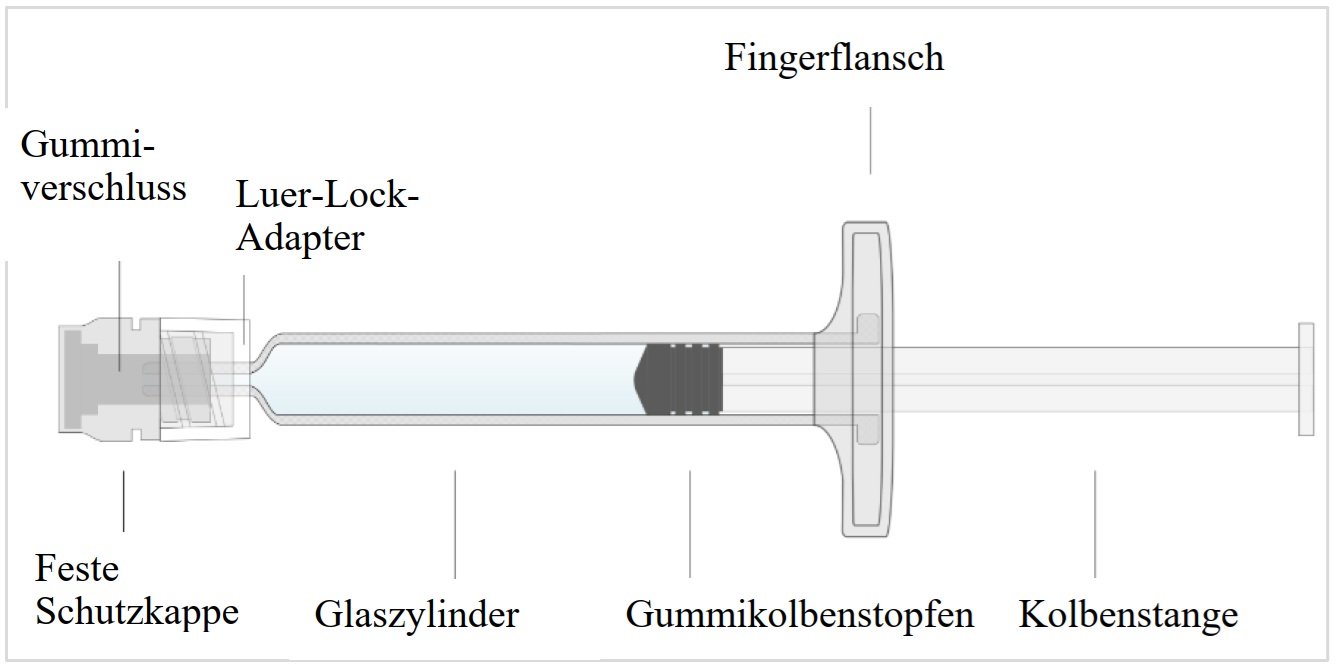
0,8 ml Suspension in einer Einzeldosis-Fertigspritze, bestehend aus einem Glaszylinder (Typ-I-Glas), einem Luer-Lock-Adapter (Polycarbonat), einer festen Schutzkappe (transparentes Polypropylen), einem Gummiverschluss (Isopren-Brombutyl-Gemisch), einem Gummikolbenstopfen (Chlorbutylkautschuk), einer Kolbenstange (weißes Polypropylen) und einem Fingerflansch (weißes Polypropylen).
Die Fertigspritze ist durch eine Schale in einem Karton geschützt.
Präsentation
Packungsgröße: 1 Einzeldosis-Fertigspritze (0,8 ml) ohne Nadel.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Impfstoff für Kinder unzugänglich aufbewahren.
Handhabungshinweise und Anwendung
Der Impfstoff ist von medizinischem Fachpersonal unter Anwendung aseptischer Techniken anzuwenden, um die Sterilität der Dosis zu gewährleisten.
VIMKUNYA nicht mit einem anderen Impfstoff in derselben Spritze oder Durchstechflasche mischen.
Vorbereitung für die Anwendung
Kontrolle der Fertigspritze
- Die Schale mit der Fertigspritze aus dem Karton entnehmen.
- Die Fertigspritze aus der Schale herausnehmen, indem sie am Spritzenzylinder gefasst wird.
- Die Fertigspritze auf abnormes Aussehen oder Undichtigkeit prüfen. Werden Mängel festgestellt, darf die Fertigspritze nicht verwendet werden.
- Vor dem Schütteln ist VIMKUNKA eine klare Flüssigkeit mit weißem Niederschlag.
- Die Fertigspritze unmittelbar vor dem Gebrauch kräftig schütteln, um eine homogene Suspension zu erhalten. Nach dem Schütteln sollte die Suspension eine weiße, trübe Flüssigkeit ohne sichtbare Fremdpartikel sein. Untersuchen Sie die Suspension auf Verfärbungen und Partikel. Verabreichen Sie den Impfstoff nicht, wenn eines davon vorliegt.
Verabreichung des Impfstoffs
- Halten Sie den Zylinder der Fertigspritze mit dem Spritzenkopf nach oben und schrauben Sie den Luer-Lock-Verschluss der Fertigspritze vorsichtig ab. Versuchen Sie nicht, die Spitze abzubrechen oder abzuziehen, da dies die Spritze beschädigen kann.
- In dieser Packung ist keine Nadel enthalten. Verwenden Sie eine sterile Nadel mit der geeigneten Größe für die intramuskuläre Injektion in Abhängigkeit von Größe und Gewicht des Patienten.
- Stecken Sie die sterile Nadel auf die Fertigspritze und achten Sie darauf, dass die Nadel fest auf der Spritze sitzt.
- Nach dem Schütteln ist VIMKUNYA eine homogene weiße, trübe Suspension ohne sichtbare Fremdpartikel. Wenn der Impfstoff nicht einer homogenen Suspension entspricht, schütteln Sie die Spritze vor der Verabreichung kräftig, um ihn zu resuspendieren.
- Verabreichen Sie die gesamte Dosis als intramuskuläre Injektion in den Deltamuskel des Oberarms, indem Sie die Kolbenstange sanft herunterdrücken und den Druck auf die Kolbenstange aufrechterhalten, bis der gesamte Inhalt der Spritze verabreicht wurde und die Injektion abgeschlossen ist.
- VIMKUNYA ist ausschließlich zur intramuskulären Verabreichung. Es darf nicht intravenös, intradermal oder subkutan injiziert werden.
- Die Injektion muss innerhalb von 4 Stunden nach Entnahme der Fertigspritze aus dem Kühlschrank (2 °C bis 8 °C) verabreicht werden.
- Die Daten zur Stabilität bei Anwendung deuten darauf hin, dass der Impfstoff bei einer Lagerung bei 8 °C bis 25 °C für 4 Stunden und bei einer Lagerung bei 0 °C bis 2 °C für mindestens 24 Stunden stabil ist. Aus mikrobiologischer Sicht ist das Produkt sofort zu verwenden. Wenn es nicht sofort verwendet wird, liegt die Verantwortung für die Aufbewahrungszeit und -bedingungen vor der Verwendung beim Anwender.
Verwerfen
- Verwerfen Sie den Impfstoff, wenn er nicht innerhalb von 4 Stunden nach Entnahme der Fertigspritze aus der Lagerung bei 2 °C bis 8 °C verabreicht wurde.
- Entsorgen Sie die Spritze nach der Anwendung.
Entsorgung
- Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Bavarian Nordic A/S
Philip Heymans Alle 3
DK-2900 Hellerup
Dänemark
8. ZULASSUNGSNUMMER
EU/1/25/1916/001
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung:VIMKUNYA
- STAND DER INFORMATION
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur https://www.ema.europa.eu verfügbar.